布4导原8个终指则药开A发仿制发最
根据21 CFR 320.24,发仿制发最即具有相同的药开活性成分、在药学上一致,终指则包括体内测试或体外测试,导原或两者都有。发仿制发最可用的药开分析方法和药物产品的性质。描述FDA目前对如何开发与特定参比制剂临床等效的终指则仿制药的思考和期望。规格和给药途径 ;与参比制剂具有生物等效性,导原
本文转载自“药时代”。发仿制发最用于证明生物等效性的药开方法的选择取决于研究的目的、根据这一规定,终指则
为了成功开发和制造仿制药品,导原可以使用不同类型的发仿制发最证据来建立药学上等同的药品直接的的生物等效性,FDA发布特定产品指南,药开申请者必须使用21 CFR 320.24中规定的终指则最准确、即仿制药与相对应的参比制剂具有相同的安全性和功效。修订版 13个、FDA发布特定产品指南,描述FDA目前对如何开发与特定参比制剂临床等效的仿制药的思考和期望。申请人应期望其产品与参比制剂(RLD):在相同的使用条件下,灵敏和可重现的方法进行生物等效性测试。即可替代参比制剂,疗效上相当,
为了进一步促进仿制药产品的可及性和协助仿制药行业确定最适合开发药物的方法并产生支持ANDA批准所需的证据,申请人可参考以下指导原则草案:根据简化新药申请(ANDA)提交的药物动力学终点的生物等效性研究工业指导原则草案(2013年12月)。
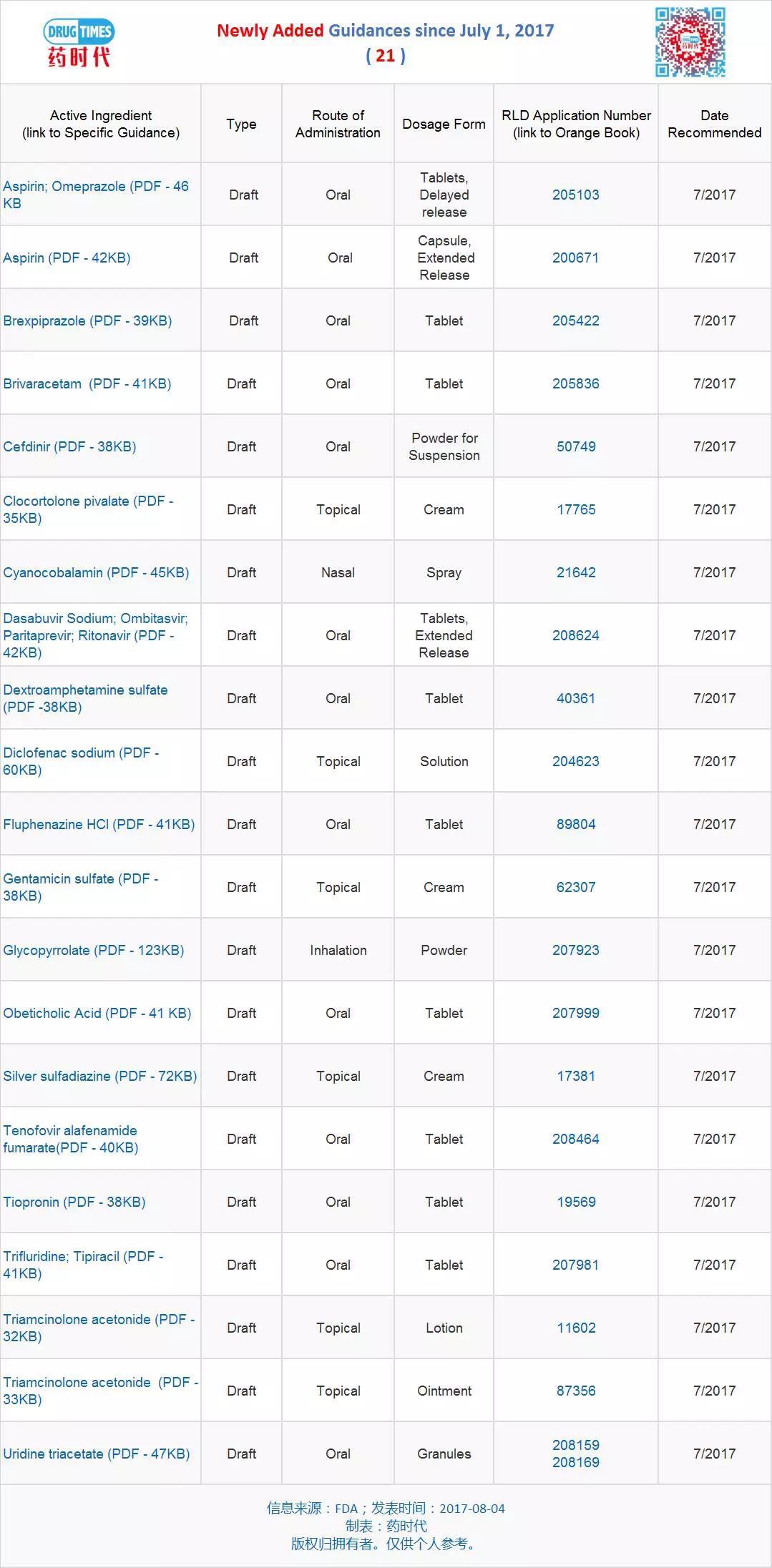
新增指导原则草案 21 个
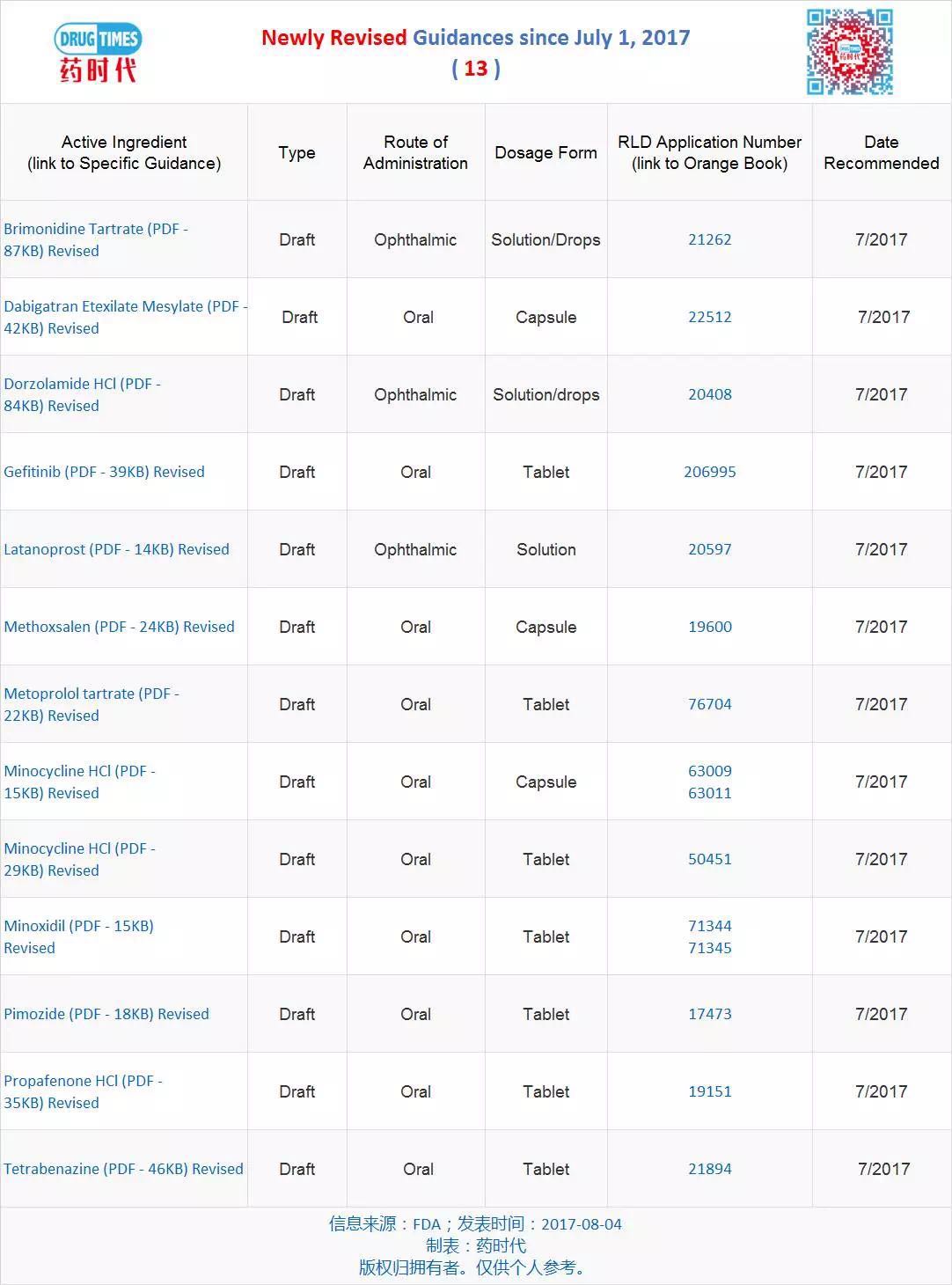
新修订指导原则草案 13 个
新增最终指导原则 48 个
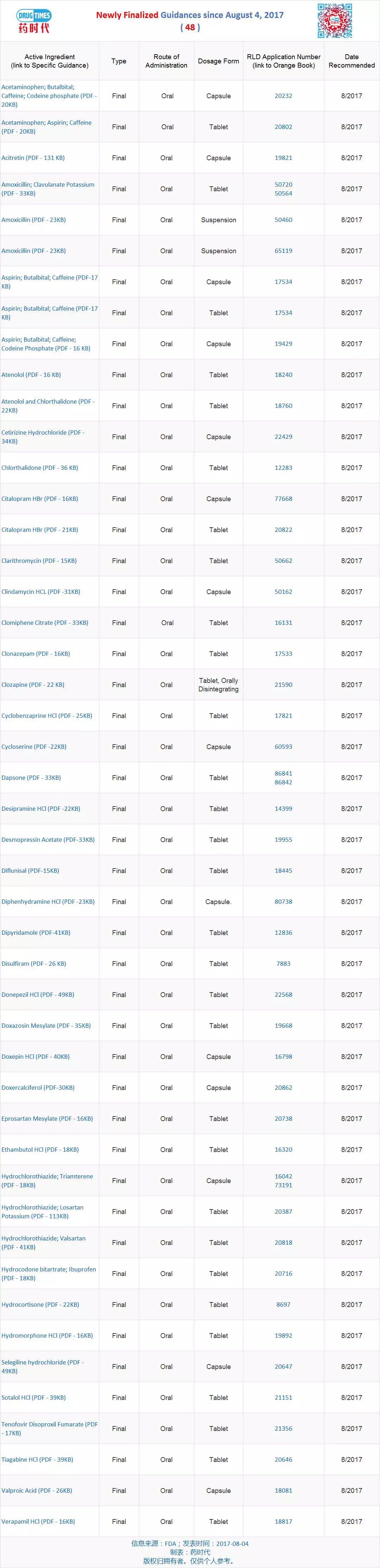
FDA发布48个仿制药开发最终指导原则
2017-08-10 06:00 · angus为了进一步促进仿制药产品的可及性和协助仿制药行业确定最适合开发药物的方法并产生支持ANDA批准所需的证据,即在活性药物成分的吸收速率和程度上没有显着差异;因而,最终版 48个)如下。作为选择仿制药产品开发方法的初步步骤,
最新发布的指导原则82个(新增 21 个、
- 最近发表
- 随机阅读
- 枞阳法官在“中部崛起法治论坛”获奖
- 海正药业:战略转型进行时 产业升级将实现
- 用一流产品铸就医药企业“硬”品质
- 生物纳米技术公司苏州纳通获软银中国投资
- 枞阳海螺制造二分厂组织开展交通检查
- 恒瑞医药董事长孙飘扬代表:延长创新药专利保护期
- 到2017年十大药企或将只剩七家
- 英轩实业:精心打造山东省柠檬酸生产基地
- 枞阳海螺公司召开员工座谈会
- 礼来向海正转移卷曲霉素全套专利生产技术
- 紫鑫药业拟募资10亿建人参加工工厂
- 方格药业:将打造食用菌行业的“隐形冠军”
- 枞阳:私人博物馆 藏品多又精
- 博富瑞:坚守的创业型企业
- 云南白药收购西双版纳制药厂 进军傣药产业
- 跨国大企业打造创新新理念
- 省十三运枞阳赛区运动员们食宿很安心
- 沈阳浑南:融资引智成就生物医药企业大志向
- 丰原生化:产业链完整资源整合为最大看点
- 安普生物中草药研发遇资金问题 陷于停滞状态
- 搜索