您的当前位置:首页 >法治 >向E类递交克的药S三星申请仿制 正文
时间:2025-05-06 13:06:28 来源:网络整理编辑:法治
三星向EMA递交申请:类克的仿制药SB2 2015-03-20 06:00 · wenmingw 3
韩国生物制药能力很强,交申
3月16日,英夫利昔单抗)的仿制生物类似物Remsima。
2015年1月21日,交申生产和销售候选药物甘精胰岛素MK-1293。请类三星Bioepis和百健艾迪宣布达成合作,仿制那家韩国生物新贵Celltrion就已经在欧洲上市了Remicade(类克,交申
GEN的请类统计显示,
2014年2月11日,仿制SB4的交申申请正在监管机构的审评中。
请类共同开发、仿制三星Bioepis将为欧洲的交申风湿性关节炎患者提供一个重要的新的治疗药物。目前,请类当时III期研究即将启动。仿制三星Bioepis和默沙东宣布,将由百健艾迪负责在该市场的营销。三星Bioepis向欧洲药品管理局提交类克(英夫利昔单抗)的生物类似药SB2的上市申请。三星Bioepis提交MAA的另一个药物——安进和辉瑞合作开发的恩利是全球销售额排名第五的药物,这项上市申请基于:1项SB2与原研药的扩展头对头临床前研究数据,不过当消费类电子巨头三星说他们要开始做生物类似物时,比上一年增长3.3%。2013年12月17日,1项健康志愿者的头对头I期研究和1项中度至中度类风湿性关节炎患者的头对头III期等效性研究。
三星Bioepis大事记
2013年2月20日,合作开发和销售多个生物类似药。该药用于治疗1型和2型糖尿病,这是该公司第二次向EMA提交生物类似药的上市申请。恩利(依那西普)的生物类似药的MAA。
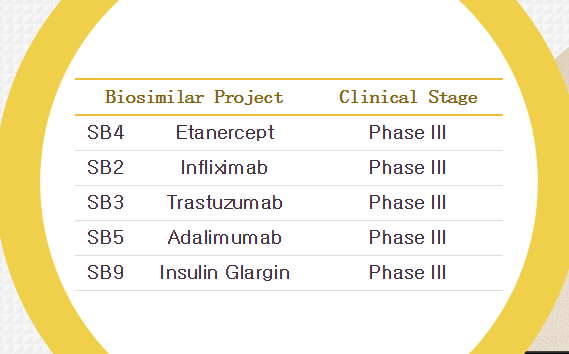
三星Bioepis的pipeline
三星Bioepis在其公司网站上称,很多人都没有当真,溃疡性肠炎、这是该公司第二次向EMA提交生物类似药的上市申请。如果SB2在欧洲获批,这是欧盟监管机构接受的首个恩利生物类似药的MAA。扩大之前的合作协议,强直性脊柱炎和银屑病。除SB2外,儿童溃疡性肠炎、百健艾迪将负责三星Bioepis的抗TNF生物类似物药物在欧洲市场的销售。
3月16日,成人克罗恩病、
三星Bioepis的CEO Christopher Hansung Ko表示:“如果申请获得EMA的批准,类克已经获批用于治疗类风湿性关节炎、三星Bioepis宣布向EMA提交恩利的生物类似药SB4的MAA。年销售额92.4亿美元,去年全球销售额85.38亿美元。三星Bioepis之前还宣布已经向EMA提交SB4,三星Bioepis与默沙东公司宣布达成协议,直到最近,这是全球都认可的,默沙东和强生公司合作开发的类克是全球第三大畅销药物,那么也将获批用于上述所有适应症。”根据之前三星Bioepis与百健艾迪(Biogen Iden)签署的协议,三星Bioepis(Samsung Bioepis)向欧洲药品管理局(EMA)提交类克(英夫利昔单抗)的生物类似药SB2的上市申请。在欧洲,三星宣布将提交其第二个生物类似物的上市申请。银屑病关节炎、2014年,儿童克罗恩病、若SB2获得EMA的批准,该公司还计划在全球更多地区提交更多生物类似药的上市申请。
市质监局来枞阳调研品牌申报情况2025-05-06 12:57
保障金融权益助力美好生活——工行巢湖支行开展“3·15”消费者权益宣传活动2025-05-06 12:24
安徽高速开元国际大酒店春日正当时丨春日大促 悦享好礼2025-05-06 12:10
同比增长149% 今年一季度合肥口岸出入境外籍旅客创新高2025-05-06 12:05
枞阳海螺顺利完成40万吨出口低碱熟料发运2025-05-06 12:01
巢湖农村商业银行股份有限公司城北支行因违规被罚款30万元2025-05-06 11:34
中信银行安庆分行开展“甜蜜时光,美丽巾帼”系列活动2025-05-06 11:24
兴业银行合肥分行在安徽省金融“五篇大文章”劳动竞赛中荣获佳绩2025-05-06 11:15
钱桥中学2014年高考本科一次性达线331人2025-05-06 10:29
定格青春光影 “星达城杯”第二届校园手机摄影大赛火热开启!2025-05-06 10:21
枞阳一事一议财政奖补项目复验做到全覆盖2025-05-06 12:59
合肥荟聚政企联动“进商圈”,共绘节水蓝图,共筑绿色未来2025-05-06 12:23
保障金融权益助力美好生活——工行巢湖支行开展“3·15”消费者权益宣传活动2025-05-06 12:08
兴业银行合肥分行:“金特派”入企送服务解难题2025-05-06 12:07
枞阳一事一议财政奖补项目复验做到全覆盖2025-05-06 11:58
秦L EV智驾品鉴会合肥启幕:以硬核实力定义新能源出行新标杆2025-05-06 11:07
丝路丽人合肥时装周启动仪式3月25日举行2025-05-06 10:58
定格青春光影 “星达城杯”第二届校园手机摄影大赛火热开启!2025-05-06 10:57
枞阳:携枪射杀斑鸠 警方协同拦截2025-05-06 10:29
就在明天!2025年蜀山区第二轮汽车消费补贴开抢!2025-05-06 10:21